Портосистемные (портокавальные) шунты — это неправильные сосудистые соединения между печеночной портальной веной (кровеносным сосудом, который соединяет желудочно-кишечный тракт с печенью) и системным кровообращением (Рис.2, 2а). Такие аномальные анастомозы направляют кровь от желудочно-кишечного тракта в системный кровоток, минуя печень и тем самым ограничивая жизненно важные функции печени в метаболизме и детоксикации продуктов обмена, а также барьерные функции защиты от кишечных болезнетворных микроорганизмов. В значительной степени такие нарушения подвергают организм влиянию токсичных продуктов пищеварения и проявляются симптомами печеночной недостаточности.
Рис.2, 2а. Схемы патологического портального кровотока
Портосистемные шунты могут быть как врожденными, так и приобретенными, т. е. образованными вследствие какой-то болезни, полученной в течение жизни. Врожденные шунты более распространены и составляют приблизительно 75 % всех случаев. Классифицируются шунты согласно их местоположению как внепеченочные или внутрипеченочные.
До настоящего времени, определено шесть главных типов врожденных шунтов:
- Шунт ductus venosus — сосуд, соединяющий пупочную вену с каудальной полой веной у плода. Ductus venosus является эмбриональным венозным сосудом, выходящим из пупочной вены, который пересекает печень, впадает в печеночную вену и затем — в каудальную полую вену.
- Портокавальныйшунт — дренаж портальной вены в каудальную полую вену.
- Портально-непарный шунт — дренаж портальной вены в непарную вену.
- Соединение портальной вены и каудальной полой вены с непарной веной в сегмент полой вены преренально.
- Атрезия портальной вены (гипоплазия) с развитием множественных коллатеральных портосистемных анастомзов (ранее названный портальный фиброз).
- Гепатопортальная микроваскулярная дисплазия.
Слева — Шунт ductus venosus — сосуд, соединяющий пупочную вену с каудальной полой веной у плода.Справа — Гепатопортальная микроваскулярная дисплазия.
Портокавальный шунт — дренаж портальной вены в каудальную полую вену.
Слева — Соединение портальной вены и каудальной полой вены с непарной веной в сегмент полой вены преренально.Справа — Атрезия портальной вены (гипоплазия) с развитием множественных коллатеральных портосистемных анастомозов.
Врожденные шунты чаще встречаются у чистопородных собак. Большая предрасположенность отдельных пород к этой патологии предполагает ее генетическую обусловленность.
- Внепеченочные шунты составляют до 90 % всех случаев, они характерны для маленьких пород собак и кошек.
- Внутрипеченочные шунты распространены у собак крупных пород и не превышают 25 % случаев.
- Микроваскулярная дисплазия сосудов печени представляет собой особую форму внутрипеченочных шунтов, при которой не возникают крупные сосудистые анастомозы.
Приобретенные портокавальные шунты образуются как вторичное осложнение при патологиях, приводящих к длительному повышению портального давления.
Хроническая портальная гипертензия способствует открытию атрофированных эмбриональных сосудистых сетей или образованию новых соединений.
Чаще всего такие шунты встречаются у взрослых собак с циррозом, новообразованиями или воспалительными заболеваниями печени. В отличие от врожденных шунтов, при приобретенных обычно образуются множественные анастомозы.
Важным вопросом для заводчиков является вопрос генетической обусловленности данного заболевания.
Источник: https://infovet.ru/lib/gepatologiya/portosistemnye-portokavalnye-shunty/
Трансъюгулярное внутрипеченочное портосистемное шунтирование (TIPS)
Трансюгулярное внутрипеченочное портосистемное стентирование (TIPS) представляет собой эндоваскулярную операцию по созданию искусственного канала в печени, который обеспечивает отток крови из воротной вены в нижнюю полую вену, минуя пораженную печеночную ткань.
Операция эффективно останавливает кровотечения из варикозных вен пищевода и уменьшает асцит, за счет снижения давления в воротной вене, которое всегда повышено при циррозе печени.
Операция проводится в рентгеноперационной под контролем ангиографии. Во время вмшетельства используются контрастные вещества и ультразвуковое сканирование печени. Средняя продолжительность вмешательства около 2 часов.
Сосудистые хирурги Инновационного сосудистого центра с 2004 года занимались проблемой лечения осложнений портальной гипертензии, выполняя открытые портокавальные вмешательства. С 2011 года в нашей клинике появилась возможность выполнять эндоваскулярные операции взамен более опасных открытых вмешательств.
Для операций TIPS мы берем пациентов с печеночной формой портальной гипертензии и осложненной тяжелым варикозным расширением вен пищевода, либо уже после состоявшегося пищеводного кровотечения. После обследования мы принимаем решение о виде оперативного вмешательства.
Эндоваскулярная операция порто-кавального соустья уменьшает сопротивление сосудов печени путем создания альтернативного пути венозного кровообращения в брюшной полости.
Создание шунта из воротной вены в печеночную позволяет портальной крови переходить в системный кровоток минуя расширенные вены в области пищевода.
Эта операция эффективно снижает венозное давление в воротной вене и предупреждает осложнения портальной гипертензии.
Мы считаем данную операцию показанной при печеночной форме портальной гипертензии в следующих случаях:
- Кровотечение из варикозно-расширенных вен пищевода ( в экстренном порядке)
- Для профилактики повторных кровотечений после уже перенесенных
- При варикозном расширении пищеводных вен 3-4 степени
- Устойчивая к мочегонным препаратам водянка живота (асцит) на фоне портальной гипертензии
Для определения вида портальной гипертензии необходимо выполнить визуализацию структуры печени, проходимость вен воротной системы и определить степень портальной гипертензии и ее риски.
Необходимые методы диагностики:
- УЗИ внутренних органов живота (печени, селезенки, поджелудочной железы) — дают возможность оценить степень поражения печени, выявить опухоли печени и поджелудочной железы, увеличение селезенки.
- УЗИ воротной вены позволяет получить общую информацию о размере и проходимости воротной вены.
- МРТ внутренних органов и вен брюшной полости — в сосудистом режиме позволяет оценить проходимость воротной вены
- Компьютерная томография с ангиографией аорты и венозной фазы — позволяет получить общую оценку воротной системы и варикозных вен в брюшной полости
- Прямая портография (чрезпеченочное введение катетера и контрастирование воротной системы) — заключительный метод диагностики перед вмешательством.
За неделю до операции мы переводим пациентов на диету с ограничением белковых продуктов. Это делается для того, чтобы избежать развития энцефалопатии в раннем послеоперационном периоде.
Накануне вмешательства даются слабительные препараты и ставится очистительная клизма, дается легкий ужин.
Операция проводится под местной анестезией мест проколов. Анестезиолог присутствует в операционной, для контроля над жизненно-важными функциями организма.
Пациенту устанавливается мочевой катетер и монитор для измерения артериального давления и снятия ЭКГ.
Трансюгулярное внутрипеченочное портосистемное шунтирование проводится под рентгеноскопическим контролем с использованием ультразвукового сканирования для контроля доступов к сосудам.
Доступ к печеночной вене осуществляется через внутреннюю яремную вену на шее. Для облегчения доступа используется ультразвуковой контроль. После пункции устанавливается проводник и интродьюсер. Проводник с катетером проводятся в нижнюю полую и печеночную вену. После установки катетера в печеночной вене измеряется давление прямым методом, чтобы рассчитать в последующем градиент.
Для поиска ветви воротной вены может использоваться УЗИ навигация, либо проводится пункция печени под УЗИ контролем и проводится контрастное исследование портальной системы с использованием функции roadmap.
После определения целевой воротной вены через катетер в печеночной вене проводится пункция специальной иглой. Проведя последнюю в воротную вену через нее устанавливают проводник и проводят катетер. Проводится контрастирование воротной системы через яремный катетер и замеряется давление в воротной системе.
Через паренхиму печени по проводнику проводится баллон, который затем раздувается создавая канал в печеночной ткани. После извлечения баллона по проводнику проводится специальный стент-графт, представляющий собой трубчатую металлическую сетку покрытую внутри специальным герметичным пластиком.
Таким образом, мы соединяем прямым шунтом воротную и печеночную вену, что способствует снижению давления в воротной системе и предупреждает рецидивы кровотечения.
После измерения давлени в воротной системе все инструменты удаляются, а пациент помещается в палату наблюдения.
В руках опытного хирурга частота опасных осложнений составляет менее 1%. Очень редко может развиться внутрибрюшное кровотечение или абсцесс печени.
Чаще встречаются осложнения, связанные с успехом процедуры. Прямой поток крови из кишечника может привести к увеличению поступления в системный кровоток азотистых шлаков и развитие энцефалопатии.
Проявления энцефалопатии (тремор, бессоница, спутанность сознания) наблюдаются у 25% прооперированных пациентов, однако у большинства пациентов эти симптомы проходят в течение недели после операции. Для предупреждения энцефалопатии необходимо уменьшить потребление белковой пищи.
Недостаточность кровоснабжения печени — ишемический гепатит является более редким осложнением, так как при портальной гипертензии основное кровообращение печень получает за счет печеночной артерии.
Однако в некоторых случаях, создание шунта может вызвать ишемическое повреждение печени с острой печеночной недостаточностью, что может потребовать срочного закрытия шунта.
Редким, но серьезным осложнением является развитие инфекционного процесса в зоне вмешательства, то есть нагноения стент-графта. Для предупреждения подобного осложнения в послеоперационном периоде применяются сильные антибиотики.
Важно понимать, что портокавальные анастомозы не лечат цирроз печени, но устраняют опасные для жизни осложнения. Пациенты с функционирующим шунтом имеют меньший риск умереть от желудочно-кишечного кровотечения, однако сохраняется риски связанные с печеночной недостаточности.
В целом TIPS позволяет избежать преждевременного неблагоприятного исхода связанного с кровотечениеми и часто применяется как предварительное вмешательство перед пересадкой печени.
Контроль за функцией шунта осуществляется как с помощью прямых методов визуализации, так и косвенных.
Из косвенных признаков важным является уменьшение диаметра вен в подслизистом слое перехода из пищевода в желудок. Это позволяет иметь уверенность, что рецидива кровотечения не будет. ЭГДС мы рекомендуем выполнять через неделю и через месяц после вмешательства, а затем раз в 6 месяцев.
При ультразвуковом сканировании отмечается кровоток по шунту и определяется его скорость. Оценивается диаметр воротной вены и размеры селезенки. Так же можно отметить уменьшение асцита. УЗИ рекомендуем выполнять каждые 3 месяца у нашего специалиста.
Через год после вмешательства мы рекомендуем выполнить МСКТ ангиографию брюшной полости с оценкой венозной фазы. При этом хорошо выявляется функционирующий стент.
Источник: https://angioclinic.ru/metodiki/tips/
Коронарное шунтирование: показания, противопоказания, результаты
Операция по аортокоронарному шунтированию (АКШ) проводится в отношении больных с ишемической болезнью сердца (ИБС) для улучшения качества жизни и снижения смертности в результате сердечной недостаточности.
В 1953 году Уильям Мустард выполнил первый прямой хирургический доступ к коронарному кровообращению: шунтирование сонной артерии у пациента в Торонто.
В 1962 году была проведена первая хирургическая процедура реваскуляризации миокарда, метод лоскутного трансплантата, для устранения обструкции коронарной артерии левого главного ствола.
Впоследствии, трансплантация подкожной вены стала доминирующим подходом.
Вскоре после этого шунтирование коронарной артерии стало наиболее часто проводимой хирургической процедурой.
Впоследствии были продемонстрированы преимущества использования левой внутренней грудной артерии.
Лучшие показатели долгосрочной проходимости и улучшенная поздняя выживаемость были достигнуты при использовании левой внутренней грудной артерии, чем при использовании трансплантации подкожной вены.
С 1986 года левая внутренняя грудная артерия используется в более чем в 90% процедур коронарного шунтирования. Реже используется правая внутренняя грудная артерия. Трансплантаты лучевой артерии имеют примерно такую же 1-летнюю степень проходимости, что и трансплантация подкожной вены.
Использование этих методов как вызывает обеспокоенность по поводу возможного нарушения заживления стернотомии и инфекции, но это может быть рассмотрено, если риск не использования обоих сосудов превышает риск инфицирования 2,5% (например, если у пациента нет хороших венозных каналов) и не достаточно для необходимого количества обходных участков приземления). Большинство операций коронарного шунтирования заключаются в размещении одного или нескольких трансплантатов подкожной вены в дополнение к использованию левой внутренней грудной артерии.
Показания
Показания к назначению делятся на три класса.
Показания класса I следующие:
- Болезнь левой основной коронарной артерии с сужением на 50% или более
- Анатомически эквивалентный болезни левой основной коронарной артерии с 70% или более сужением как в проксимальной левой передней нисходящей коронарной артерии, так и в левой периферической артерии
- Ишемическая болезнь трех сосудов (ИБС), особенно в условиях нарушения фракции выброса левого желудочка
Показания класса II следующие:
- Проксимальный стеноз коронарной артерии
- Однососудистая или двухсосудистая ишемическая болезнь сердца, которая не затрагивает проксимальную коронарную артерию, если существует риск умеренной зоны жизнеспособного миокарда
Показания класса III следующие:
- Ишемическая болезнь сердца с одним или двумя сосудами, которая не включает проксимальную коронарную артерию
- Однососудистая или двухсосудистая ИБС, в которой не задействована проксимальная коронарная артерия только с небольшой областью жизнеспособного миокарда
Ожидаемая польза от операции должна быть сопоставлена с осложнениями и смертностью. Совершенствование оперативных методов и технологий позволило хирургическое лечение более сложных случаев.
Ранние исследования, сравнивающие АКШ с коронарным вмешательством при многососудистом заболевании, показали, что две стратегии имели одинаковую смертность, но существует повышенная потребность в повторных процедурах в ангиопластике и голых металлических стентах. Отдельные исследования продемонстрировали улучшение смертности в диабетических подгруппах, которые подвергаются хирургической реваскуляризации, несмотря на то, что эти результаты не были универсальными.
До широкого использования стентов с лекарственным покрытием основные преимущества коронарного вмешательства по сравнению с чрескожным коронарным вмешательством включали более низкую частоту повторных процедур, больший успех при хронически закупоренных коронарных артериях и защиту всего сосуда, ближайшего к дистальному анастомозу. трансплантат молочной железы. Основным недостатком коронарного шунтирования является более высокий уровень авансовых рисков и осложнений.
Стенты с лекарственным покрытием имеют улучшенные результаты ЧКВ, особенно в отношении повторной реваскуляризации, и есть надежда, что уменьшение рестеноза с помощью стентов с лекарственным покрытием уменьшит необходимость повторных процедур у пациентов с многососудистым заболеванием, которое лечилось ЧКВ.
Минимально инвазивное шунтирование коронарной артерии
Достижения в коронарном шунтировании позволили хирургам избежать необходимости выполнять срединную стернотомию, тем самым уменьшая боль и респираторные осложнения и предотвращая большой рубец, связанный с этим разрезом.
Минимально инвазивная АКШ включает в себя хирургические методы, которые позволяют получить доступ к сердцу через небольшие торакотомические разрезы с помощью эндоскопической роботизированной хирургии с использованием компьютерной системы телеманипуляции.
Препроцедурное обследование
Перед выполнением коронарного шунтирования клинические врачи должны тщательно изучить историю болезни пациента на наличие факторов, которые могут привести к осложнениям, в том числе следующие:
-
Недавно перенесенный инфаркт миокарда
-
Предшествующая кардиохирургическая операция
-
Условия, которые могу привести к кровотечению
-
Цереброваскулярное заболевание, в том числе шумы над сонной артерией и транзиторная ишемическая атака
-
Нарушения электролитного обмена, которые могут предрасполагать больного к дисритмии
-
Инфекционные процессы, в том числе инфекцию мочевыводящих путей и др.
-
Хроническая обструктивная болезнь легких (ХОБЛ) или инфекции.
Стандартные предоперационные исследования могут включать в себя:
-
Исследование уровня креатинина и электролитов (аномалии обсуждаются и корректируются с анестезиологом)
-
Функциональные пробы печени
-
Тест на метициллинрезистентный золотистый стафилококк
-
Рентгенография грудной клетки
-
Электрокардиография (ЭКГ)
-
Эхокардиография или вентрикулография (для оценки функции левого желудочка)
-
Коронарная ангиография (для определения степени и местоположения ИБС)
Модели риска для прогнозирования 30-дневной смертности после изолированного коронарного шунтирования является активной областью исследования. Модели риска являются наиболее часто используемыми предикторами в кардиохирургии.
Общие переменные в моделях учитывают возраст пациента, перенесенный инфаркт миокарда, заболевание периферических сосудов, почечную недостаточность, гемодинамическое состояние. Дисперсии объясняется восемью наиболее важными переменными, которые включают возраст, степень хирургического вмешательства, состояние после операции, уровень креатинина, диализ, шок, хроническое заболевание легких.
Целью премедикации является минимизация потребности кислорода в миокарде за счет снижения частоты сердечных сокращений и системного артериального давления, а также улучшения кровотока в миокарде с помощью применения вазодилататоров.
Лекарственные препараты, которые следует принимать до момента операции, следующие:
-
Бета-блокаторы, блокаторы кальциевых каналов и нитраты
Перед операцией используются препараты:
-
Темазепам сразу перед операцией
Транексамовая кислота (1 г болюса до хирургического разреза с последующей инфузией 400 мг / час во время операции) может использоваться для уменьшения количества послеоперационных кровотечений из средостения и количества используемых продуктов крови (т.е. эритроциты и свежезамороженная плазма).
Кардиохирургическая операция обычно выполняется под общим эндотрахеальным наркозом.
В редких случаях используются следующие два вида нейроаксиальной блокады (действует на спинной мозг):
-
Интратекальная инфузия опиоидов
-
Торакальная эпидуральная анестезия (как правило низкодозированное местное введение анестетика / инфузия опиоидов)
В дополнение к обычному анестезиологическому мониторингу (ЭКГ, пульсоксиметрия, температура носоглотки, мочеиспускание, газовый анализ), особые требования к мониторингу при кардиохирургии включают в себя следующее:
-
Инвазивное измерение кровяного давления
-
Центральный венозный доступ
-
Чреспищеводная эхокардиография
-
Неврологический мониторинг
-
Мониторинг оксигенации головного мозга
-
Мониторинг давления в легочной артерии
Участки, в которых проводится коронарное шунтирование, включают в себя следующие:
-
Левая внутренняя грудная артерия
-
Правая внутренняя грудная артерия
-
Правая желудочно-сальниковая артерия
-
Нижняя эпигастральная артерия
Шунтирование коронарной артерии сопряжено с риском осложнений и смертности и, следовательно, не считается целесообразным к назначению для лиц, не имеющих симптомов, у которых имеется низкий риск инфаркта миокарда. Больные, которым коронарное шунтирование принесет незначительную пользу от также исключаются.
АКШ выполняется у пожилых больных для облегчения симптомов. Несмотря на то, что пожилой возраст не является противопоказанием, АКШ следует с осторожностью назначать у пожилых людей, в особенности старше 85 лет.
Такие лица также чаще испытывают осложнения во время и после операции после АКШ.
Междисциплинарный подход в работе врачей, который делает акцент на совместном принятии решений для больных со сложным заболеванием коронарной артерии, необходим для того, чтобы предложить больному наилучшие шансы на успешную стратегию реваскуляризации.
Результаты
У больных с многососудистой коронарной болезнью коронарное шунтирование, по сравнению с чрескожным коронарным вмешательством, приводит к уменьшению смертности в долгосрочной перспективе и случаев инфаркта миокарда, а также к снижению необходимости повторных реваскуляризаций (вне зависимости от того, имеются ли у пациентов диабет).
В мета-анализе из 8-ми рандомизированных исследований, включавших в общей сложности 3612 взрослых больных, страдающих диабетом и ишемической болезнью сердца, лечение с помощью АКШ значительно понизило риск смертности от всех причин на 33% в течение 5 лет по сравнению с ЧКВ.
Источник: https://cardio-bolezni.ru/koronarnoe-shuntirovanie-pokazaniya-protivopokazaniya-rezultaty/
Портосистемное шунтирование
(рис. 10-60)
Портосистемное шунтирование выполняют
с целью снижения давления в воротной
вене, поддержания общего печёночного
и, в частности, портального кровотока
и, самое главное, для снижения риска
печёночной энцефалопатии, осложняющей
портальную гипертензию. Ни один из
существующих в настоящее время
методов шунтирования не позволяет
полностью достичь этой цели. Выживаемость
больных определяется функциональным
резервом печени, так как после
шунтирования печёночно-клеточная
функция ухудшается.
Портокавальное
шунтирование
В 1877г. Экк [38]впервые выполнил портокавальное
шунтирование на собаках; в настоящее
время это наиболее эффективный метод
уменьшения портальной гипертензии.
Воротную вену соединяют с нижней полой
веной либо конец в бок с перевязкой
воротной вены, либо бок в бок, не нарушая
её непрерывности. Давление в воротной
и печёночной венах снижается, а в
печёночной артерии увеличивается
кровоток.
Соединение конец в бок, вероятно,
обеспечивает более выраженное
снижение давления в воротной вене,
составляющее примерно 10мм рт.ст. Технически эту операцию
выполнить проще.
В настоящее время портокавальный шунт
накладывают редко, поскольку он часто
осложняется энцефалопатией. Уменьшение
печёночного кровотока ухудшает
функцию печени. Это затрудняет в
последующем трансплантацию этого
органа.
К наложению портокавального
шунта по-прежнему прибегают после
остановки кровотечения, при хорошем
функциональном резерве печени, при
отсутствии возможности наблюдать
за больным в специализированном центре
или если имеется риск кровотечения из
варикозно-расширенных вен желудка.
Оно показано также на начальных стадиях
ПБЦ, при врождённом фиброзе печени с
сохранной функцией гепатоцитов и
обструкции воротной вены в области
ворот печени.
После портокавального шунтирования
уменьшается вероятность асцита,
спонтанного бактериального перитонита
и гепаторенального синдрома.
При оценке показаний к шунтированию
важное значение имеют указание в анамнезе
на кровотечение из варикозно-расширенных
вен пищевода, наличие портальной
гипертензии, сохранность воротной
вены, возраст моложе 50лет, отсутствие в анамнезе эпизодов
печёночной энцефалопатии, принадлежность
к группе А или В по Чайлду. У больных
старше 40лет выживаемость
после операции ниже и в 2раза повышается частота развития
энцефалопатии.
Рис.
10-60.Варианты портосистемного
шунтирования для устранения портальной
гипертензии.
Мезентерикокавальное
шунтирование
При мезентерикокавальном шунтировании
шунт из дакронового протеза вшивают
между верхней брыжеечной и нижней полой
веной (рис. 10-61).
Рис.
10-62.Дистальный спленоренальный
шунт. Перевязаны вены, через которые
заполняются варикозно-расширенные
вены пищевода: венечная вена желудка,
правая желудочная вена, правая
желудочно-сальниковая вена.
Нaлoжeн спленоренальный шунт с
сохранением селезёнки. Возможен
ретроградный кровоток по коротким
желудочным венам. Кровоток по воротной
вене сохраняется.
Техника операции проста. Просвет воротной
вены не закрывается, но кровоток по ней
становится незначительным. Со временем
часто происходит окклюзия шунта, после
которой возможны рецидивы кровотечения
[36].Мезентерикокавальный шунт не
усложняет трансплантацию печени в
последующем.
Селективное
«дистальное» спленоренальное шунтирование(рис. 10-62)
При селективном спленоренальном
шунтировании пересекают
варикозно-расширенные вены в области
желудочно-пищеводного перехода, в
результате кровь направляется через
короткие желудочно-селезёночные вены
в селезёночную вену, анастомозированную
с левой почечной. Предполагалось, что
кровообращение в воротной вене при этом
сохранится, но, как оказалось, этого
не происходит.
Предварительные результаты операции
были удовлетворительными; смертность
составляла 4,1%,частота
развития энцефалопатии —
12%,5-летняя выживаемость
— 49%.
В последующем в более крупном
рандомизированном исследовании у
больных с алкогольным циррозом печени
установлено, что смертность и частота
развития энцефалопатии при этом не
отличаются от аналогичных показателей
при неселективном спленоренальном
шунтировании.
При неалкогольном циррозе
получены более благоприятные
результаты, особенно в тех случаях,
когда варикозное расширение вен
желудка являлось основной проблемой
[94].
Кроме того, применение этого
метода оправдан при кровотечении из
варикозно-расширенных вен при шистосомозе,
нецирротической портальной гипертензии
с расширенной селезёночной веной.
Операция не мешает проведению в
последующем трансплантации печени.
Техника дистального спленоренального
шунтирования сложна, и хирургов,
владеющих ею, немного.
Общие результаты портосистемного
шунтирования
В группе низкого риска операционная
летальность составляет примерно
5%.В группе высокого риска она
достигает 50%.
При операции на поражённой патологическим
процессом воротной вене шунт часто
закрывается; это осложнение нередко
заканчивается смертью, причиной
которой часто является печёночная
недостаточность.
При нормальном функционировании
портокавального анастомоза, наложенного
конец в бок, кровотечение из
варикозно-расширенных вен пищевода
и желудка удаётся предотвратить.
После шунтирования венозные коллатерали
передней брюшной стенки исчезают, а
размеры селезёнки уменьшаются. При
эндоскопии через 6-12мес
варикозное расширение вен не выявляют.
Если шунт неселективный, снижается как
портальное давление, так и печёночный
кровоток. В результате этого функция
печени ухудшается.
В послеоперационном периоде часто
развивается желтуха, обусловленная
гемолизом и ухудшением функции
печени.
Снижение давления в воротной вене на
фоне сохранения низкого уровня альбумина
вызывает отёк лодыжек. Увеличение
сердечного выброса, сочетающееся с
сердечной недостаточностью, также
может играть роль в его развитии.
Проходимость шунта контролируют с
помощью УЗИ, КТ, МРТ, допплеровского УЗИ
или ангиографии.
Печёночная энцефалопатия может быть
преходящей. В 20—40%случаев развиваются хронические
изменения и приблизительно в трети
случаев —изменения
личности (см. главу 7).Их
частота тем выше, чем больше диаметр
шунта. Наиболее вероятно их развитие
при прогрессировании заболевания
печени. Энцефалопатия чаще встречается
у пожилых больных.
Кроме того, шунтирование может осложняться
параплегией, обусловленной миелопатией,
паркинсонизмом и симптомами поражения
мозжечка (см. главу 7).
Трансъюгулярное внутрипеченочное
портосистемное шунтирование
Первые попытки создания внутрипеченочных
портосистемных шунтов у собак
[126]и у человека[27]оказались неудачными, поскольку
создаваемое с помощью баллона сообщение
между печёночной и воротной веной быстро
закрывалось.
Сохранение проходимости
шунта оказалось возможным при использовании
расправляющегося стентаPalmaz,
который устанавливают между внутрипеченочной
ветвью воротной вены и ветвью печёночной
вены (рис.
10-63и
10-64) [28, 125, 128, 143, 178].
Обычно ТВПШ выполняют для остановки
кровотечения из варикозно-расширенных
вен пищевода или желудка. Однако,
прежде чем прибегнуть к этому методу
лечения, необходимо убедиться в
безуспешности других методов, в частности
склеротерапии и введения вазоактивных
препаратов [58].
При
продолжающемся кровотечении результаты
оказываются неблагоприятными. Процедуру
проводят под местной анестезией после
премедикации седативными препаратами.
Под контролем УЗИ выявляют бифуркацию
воротной вены.
Через яремную вену
катетеризируют среднюю печёночную
вену, и через этот катетер проводят
иглу в ветвь воротной вены. Через иглу
устанавливают проводник и по нему
вводят катетер. Иглу извлекают и
определяют градиент давления в воротной
вене. Пункционный канал расширяют
баллоном, после чего выполняют
ангиографию.
Затем вводят металлический
баллонный расправляющийся стентPalmazлибо саморасправляющийся
металлический стентWallstent(42—68),имеющий диаметр
8—12мм [73].Диаметр
стента подбирают таким образом, чтобы
градиент портального давления
оказался ниже 12мм рт.ст.
Если портальная гипертензия сохраняется,
параллельно первому можно установить
второй стент [571.Всю
процедуру выполняют под контролем УЗИ.
Она длится 1—2ч. ТВПШ не
мешает в последующем трансплантации
печени.
Рис.
10-63.ТВПШ. Между воротной и печёночной
веной установлен расправляющийся
металлический стент, создающий
внутрипеченочный портосистемный шунт.
Рис.
10-64.ТВПШ. Портальная венография
выявила порто-печёночный шунт, смещения
стента нет (указано стрелкой).
ТВПШ —технически сложное
вмешательство. При достаточном опыте
персонала его удаётся выполнить в
95%случаев [127|.
Тем не менее, по данным
одного исследования, технические
трудности, ранний рецидив кровотечения,
стенозирование и тромбоз шунта потребовали
повторного ТВПШ в период одной
госпитализации больного в
30%случаев [58].В
8%случаев даже после повторного
вмешательства остановить кровотечение
не удалось.
Летальность при установлении стента
составляет менее 1%,а
летальность за 30сут
—от 3% до
13% [74].Вмешательство может осложниться
кровотечением —внутрибрюшным, билиарным или под капсулу
печени. Возможно смещение стента, а
стентWallstentприходится
расправлять до прежнего состояния с
помощью петли [132].
Часто развивается инфекция, которая
может привести к смерти. Следует
профилактически вводить антибиотики
[II].
При нарушении функции почек и
после внутривенного введения большого
количества контрастного вещества может
развиваться почечная недостаточность.
Стальная сетка стента может повреждать
эритроциты и вызывать внутрисосудистый
гемолиз [134].
При ошибочной установке
стента в правую печёночную артерию
развивается инфаркт печени
[81].Гиперспленизм после шунтирования
сохраняется [133].
Стеноз и окклюзия
стента.Низкий градиент давления
между воротной и печёночной веной
способствует развитию окклюзии.
Наиболее важная причина закрытия стента
—низкий кровоток по нему. Важно
контролировать проходимость стента в
динамике.
Это можно делать путём обычной
портографии или допплеровского
[82]и дуплексного УЗИ [56],которые дают полуколичественную оценку
функционального состояния шунта.
Окклюзия шунта часто приводит к рецидиву
кровотечения из варикозно-расширенных
вен.
Ранняя окклюзия стента наблюдается в
12%случаев, обычно бывает обусловлена
тромбозом и связана с техническими
трудностями при его установке
[58].Поздние окклюзии и стеноз связаны
с чрезмерными изменениями интимы
участка печёночной вены, соединённого
со стентом [28].Чаще они
встречаются у больных группы С по
Чайлду.
Стеноз и окклюзия стента
развиваются у трети больных в течение
1года и у двух третей в течение
2лет [82]. Частота этих
осложнений зависит от эффективности
диагностики. При окклюзии стента его
ревизию производят под местной анестезией.
Можно расширить просвет стента путём
чрескожной катетеризации либо
установить другой стент [74].
Остановка
кровотечения.ТВПШ приводит к
снижению портального давления
приблизительно на50%.Если
кровотечение вызвано портальной
гипертензией, то оно останавливается
независимо от того, локализуется ли
кровоточащая вена в пищеводе, желудке
или кишечнике.
Это особенно важно при
кровотечениях, не останавливающихся
после склеротерапии и возникающих на
фоне сниженной функции печени. ТВПШ
более эффективно снижает частоту
рецидивов кровотечения, чем склеротерапия
[21],однако его влияние на выживаемость
незначительное [92,127].
Частота рецидивов кровотечения через
6мес составляет от 5% [134]до19% [73],а через
1год — 18%[127].
Энцефалопатия
после ТВПШ.Наложение неселективного
портосистемного шунта бок в бок вызывает
уменьшение портального кровоснабжения
печени, поэтому после ТВПШ функция
печени ухудшается [85].
Неудивительно, что частота развития
энцефалопатии после этого вмешательства
почти такая же (25-30%),как
после хирургического портокавального
шунтирования [138]. У 9из30больных с установленным
стентом отмечено 24 эпизода
печёночной энцефалопатии, и у
12%они возниклиdenovo[134].
Риск развития печёночной энцефалопатии
зависит от возраста больного, группы
по Чайлду и размеров шунта [124[.
Энцефалопатия наиболее выражена в
течение первого месяца после операции.
При спонтанном закрытии стента она
уменьшается.
Её можно уменьшить
установлением в функционирующий
внутрипеченочный стент другого
стента меньшего размера. Резистентная
энцефалопатия является показанием к
трансплантации печени [85].
Гипердинамический тип кровообращения,
свойственный циррозу, после ТВПШ
усугубляется. Увеличиваются сердечный
выброс и объём циркулирующей крови
[5|. Возможен застой крови во внутренних
органах. Если больной страдает
сопутствующим заболеванием сердца,
возможно развитие сердечной
недостаточности.
Другие показания.Внутрипеченочный стент, устанавливаемый
при ТВПШ, представляющий собой
портосистемный шунт, наложенный конец
в бок, позволяет уменьшить асцит у
больных группы В по Чайлду. В
контролируемых исследованиях, однако,
он оказался не более эффективным, чем
традиционные методы лечения, и не
увеличивал выживаемость
[79].
При гепаторенальном синдроме ТВПШ
улучшает состояние больных и повышает
их шансы дождаться трансплантации
печени [13,102].
ТВПШ эффективно при асците и хроническом
синдроме Бадда—Киари [103].
Выводы.ТВПШ
—действенный метод остановки
острого кровотечения из варикозно-расширенных
вен пищевода и желудка при неэффективности
склеротерапии и вазоактивных препаратов.
Его применение при рецидивирующем
кровотечении из варикозно-расширенных
вен пищевода, вероятно, должно быть
ограничено случаями печёночно-клеточной
недостаточности, при которых планируется
трансплантация печени.
Метод технически сложен и требует
определённого опыта. Стойкому
лечебному эффекту препятствуют такие
осложнения, как окклюзия стента и
развитие печёночной энцефалопатии.
ТВПШ — более простой
метод лечения и вызывает меньше
осложнений, чем хирургическое наложение
портосистемного шунта.
Можно ожидать,
что осложнении в отдалённом периоде
после установки стента будут аналогичны
наблюдаемым при хирургическом
наложении шунтов.
Источник: https://studfile.net/preview/1209055/page:20/
Операция внутрипечёночного портосистемного шунтирования
содержание
Показанием для проведения внутрипеченочного портосистемного шунтирования является портальная гипертензия, для которой характерно устойчиво повышенное кровяного давление в воротной вене. Воротная вена является основным каналом доставки крови от кишечника к печени.
Если портальную гипертензию не лечить, развиваются тяжёлые осложнения, связанные с варикозным расширением вен органов пищеварения, а также печёночная энцефалопатия (наиболее опасное осложнение, при котором угнетаются нормальные функции печени).
Следствием высокого портального давления также становится увеличение селезёнки в размерах. Возникает высокий риск кровотечений из расширенных вен, проходящих в желудке и пищеводе.
Наиболее современная и эффективная методика лечения портальной гипертензии – трансъюгулярное внутрипеченочное портосистемное шунтирование. Возможности медицинских технологий позволяют проводить такую операцию эндоскопически. Суть лечения заключается в создании сосуда (шунта), проходящего через печень и соединяющего воротную вену с одним из трёх соединяющих печень с сердцем сосудов.
Поддержание просвета имплантированного сосуда в открытом состоянии обеспечивается помещением в него стента. В результате шунт принимает на себя часть кровяного потока. Некоторый объём крови, постоянно «сбрасываемый» через имплантат обеспечивает эффект декомпрессии всей портальной системы, снижая кровяное давление в воротной вене. Риск кровотечений и варикоза существенно снижается.
2.Показания и противопоказания к внутрипечёночному портосистемному шунтированию
Наиболее частыми показаниями к имплантации шунта в портальную систему печени являются:
- острые кровотечения пищевода и желудка, связанные с варикозным расширением вен, не устраняемым терапевтически и не поддающимся другим методам лечения;
- профилактика при высоком риске кровотечений на фоне варикоза вен желудка и пищевода;
- портальная гастропатия (застой венозной крови в стенках желудка, угрожающий кровотечениями);
- гепаторенальный синдром;
- синдром Бадда-Киари (образование тромба в одной из вен, проходящих от печени к сердцу);
- рефрактерный асцит (скопление жидкости в брюшной полости);
- профилактическая хирургия после трансплантации печени при угрозе развития портальной гипертензии.
Ограничением к проведению портосистемного шунтирования могут стать тяжёлые печёночные нарушения, которые могут усугубиться после имплантации шунта.
Кроме того, следует учитывать, что попадание продуктов метаболизма, из кишечника в общее кровяное русло, минуя печень, может вызвать специфическое поражение нервной системы – портосистемную энцефалопатию.
Врач тщательно взвешивает и опирается на анамнестические сведения, оценивая существующую склонность к проявлениям энцефалопатии. Иногда побочный эффект от занесения в кровь неотфильтрованных печенью токсических веществ можно усранить посредством диеты или перестановкой стента.
Детям портосистемное шунтирование проводится, в основном, после пересадки печени. При этом возникают определённые трудности и риски, связанные с последующим ростом и изменением объёма перекачиваемой крови.
Стоит также упомянуть общие противопоказания для всех видов оперативного лечения:
- инфекционные заболевания в острой стадии;
- нарушения функции почек, сердечной деятельности;
- тяжёлые системные и психические заболевания.
Эти ограничения относительны, поэтому при наличии указанных обстоятельств в каждом конкретном случае решение о проведении операции принимается на медицинском консилиуме.
3.Техника проведения и риски операции внутрипеченочного портосистемного шунтирования
Современное медицинское оборудование позволяет проводить шунтирование печени малоинвазивно. Все манипуляции производятся под контролем мониторинга эндоскопически.
Тем не менее, операционная должна быть укомплектована и готова к проведению экстренных реанимационный мероприятий, поскольку любые вмешательства на печени несут риск кровотечений, и других стремительно развивающихся осложнений.
При необходимости (сопутствующих патологиях или трудностях оперативного доступа) шунтирование проводится путём открытой полостной операции. Такой подход удлиняет восстановительный период, но может быть оправдан в ряде случаев.
Успешность операций внутрипечёночного портосистемного шунтирования составляет 90%, однако в ходе разработки плана операции врач всегда учитывает возможные риски:
- вероятность инфицирования (как при любой другом хирургическом лечении), этот риск в разы меньше при эндоскопическом методе;
- возможные аллергические реакции на используемые препараты;
- нарушения работы почек и сердца во время действия наркоза;
- кровотечения (риск такого плана всегда учитывается при любых операциях на сосудах).
Источник: https://medintercom.ru/articles/operaciya-vnutripechyonochnogo-portosistemnogo-shuntirovaniya
Портосистемное шунтирование
Разнообразие методов хирургического портосистемного шунтирования, применяемого при лечении портальной гипертензии, служит, в некотором роде, доказательством изобретательности хирургов.
Оглавление:
Видео: В Шымкенте проводят уникальные почечные операции
Со временем, когда пройдет «эра шунтирования», большинство хирургов-стажёров не смогут увидеть шунт, который и сейчас применяют ограниченно, лишь в определённых группах пациентов (больные с нецирротическими формами портальной гипертензии, а также лица, проживающие на территориях, где нет возможности использовать новейшие медицинские технологии).
Операции портосистемного шунтирования классифицируют на селективные и неселективные. Последние редко сопровождаются развитием энцефалопатии, но они менее эффективны для остановки острого кровотечения.
Основные и наиболее популярные методы – дистальное спленоренальное шунтирование, или шунт Уоррена, и портокавальное? (мезокавальное) шунтирование с использованием политетрафторэтиленового (ПТФЭ) трансплантанта малого диаметра.
В контролируемом исследовании по сравнению дистального спленоренального шунта и эндоскопической склеротерапии было показано, что первый способ позволяет эффективнее контролировать кровотечение, однако существенных преимуществ не имеет.
Шунт Инокучи, устанавливаемый между левой желудочной и нижней полой венами, не нашёл применения нигде, кроме Японии. Возможно, это связано с техническими трудностями из-за хрупкости левой желудочной вены.
Приведённые методы портокавального шунта особенно эффективны для снижения давления в портальной системе, однако их использование сопряжено с высоким риском развития энцефалопатии. Преимущества трансплантата из ПТФЭ состоит в том, что он селективен и поддерживает портальный кровоток.
Критерием включения пациентов в исследование служил эпизод кровотечения после неудачной попытки или невозможности склеротерапии и перевязки варикозно расширенных вен. Показатель смертности в первые 30 дней при использовании шунта малого диаметра составил 20%, а после трансюгулярного шунтирования – 15%.
Уже доказано, что при портосистемном шунтировании у больных циррозом показатели послеоперационной смертности выше и составляют (в специализированных центрах у пациентов со степенью C по шкале Чайлда) 26,1%. Пятилетняя выживаемость при прогрессирующем заболевании печени ниже, а шунтирование повышает нагрузку на больного и, соответственно, риск развития энцефалопатии. В настоящее время портосистемное шунтирование не является обязательным этапом лечения цирроза печени. Крупное многоцентровое исследование, посвящённое сравнению трансюгулярного внутрипечёночного портосистемного и дистального спленоренального шунтирования, пока не завершено.
Видео: портокавальный шунт у йорка.mpg
При лечении пациентов-кандидатов на трансплантацию печени портосистемное шунтирование применяют не всегда ввиду существенного повышения риска последующего хирургического вмешательства.
Если же шунтирование неизбежно, т.е.
эффективность прочих методов лечения недостаточна, хирургическое вмешательство рекомендовано выполнять максимально далеко от ворот печени (спленоренальное или мезокавальное шунтирование).
Источник: http://ruspromedic.ru/bolezni-simptomy-lechenie/hirurgija-8/2667-portosistemnoe-shuntirovanie.html
Трансъюгулярное внутрипеченочное портосистемное шунтирование
Методика заключается в создании искусственного внутрипеченочного соустья между воротной и печеночной венами при помощи постановки сетчатого металлического стента под контролем рентгеноскопии.
Применяют для лечения осложнений портальной гипертензии. Вмешательство направлено на снижение градиента давления в венозной системе печени менее 12 мм рт.ст.
Манипуляцию выполняют в специализированных гепатологических центрах. Стентирование не исключает трансплантацию печени, если стент не заведен в воротную вену слишком далеко.
Показания к проведению шунтирования
Не поддающееся терапии острое кровотечение из варикозных вен. Отсутствие эффекта от медикаментозной терапии и эндоскопических процедур, направленных на остановку кровотечения, бывает основным показанием к портосистемному шунтированию.
Перед стентированием устанавливают зонд Сенгстакена-Блэкмора. Методика особенно эффективна при желудочных и ректальных варикозных венах.
Вторичная профилактика рецидива кровотечения из варикозных вен (в том случае, если медикаментозная или эндоскопическая профилактика неудачна).
Рефрактерный асцит снижает необходимость в проведении парацентезов с удалением больших объемов асцитической жидкости. Процедура не снижает смертность и увеличивает риск ПЭ.
Противопоказания
- Внутрипеченочные процессы (кисты, опухоли).
- Окклюзия сосудов (полный тромбоз печеночной или воротной вены).
- Сердечно-легочная патология (тяжелая легочная гипертензия, застойная сердечная недостаточность).
- Высокий риск кровотечения (MHO >1,5, количество тромбоцитов
Источник: http://neomed-dv.ru/portosistemnoe-shuntirovanie/
Внутрипеченочное портосистемное шунтирование
Трансюгулярное внутрипечёночное портосистемное шунтирование — нехирургический метод имплантации портокавального анастомоза.
Метод используют преимущественно для лечения кровотечений, которые трудно контролировать при помощи медикаментозной или эндоскопической терапии. Этот метод может быть полезен в нестандартных ситуациях, а также при оказании неотложной помощи.
Трансюгулярное внутрипечёночное портосистемное шунтирование применяют и для лечения таких осложнений портальной гипертензии, как резистентные формы асцита, гидроторакс, гастропатии, синдром Бадда-Киари и гепаторенальный синдром.
Данный метод облегчает проведение операций у пациентов с портальной гипертензией при необходимости вмешательства на печени или других органах брюшной полости, хотя перед трансплантацией печени при отсутствии специфических показаний его обычно не используют.
Шунт создают путём катетеризации печёночной вены и главной ветви внутрипечёночной части портальной вены. Ход расширяют с помощью баллонного катетера и укрепляют металлическим стентом. Разработаны различные методики трансюгулярного внутрипечёночного портосистемного шунтирования в соответствии с анатомическими особенностями.
Наиболее широко применяют модели с саморасширяющимся стентом («Wallstent», «Memotherm») или баллонные («Palmaz»). Всё большую популярность завоёвывает защищённый или частично защищённый стент-графт (например, «Viatorr»), обладающий большей раскрываемостью [60].
Ширину шунта подбирают с помощью баллонного дилататора, ориентируясь на прямое измерение величины градиента давления.
Тяжёлые жизнеугрожающие осложнения при использовании трансюгулярного внутрипечёночного портосистемного шунтирования встречаются редко. Главный недостаток метода — небольшая величина раскрытия стента.
Простейшие рентгенологические манипуляции, однако, позволяют восстановить проходимость большинства шунтов при их сужении или окклюзии.
Для диагностики стенозов шунта до появления клинических признаков рецидива кровотечения пациентам необходимы регулярное ультразвуковое допплеровское сканирование и контрольная венография через определённые промежутки времени (например, через 6 мес или менее).
При имплантации любого шунта существует риск развития энцефалопатии, который особенно значим при применении шунтов большого диаметра, у пациентов старшего возраста и больных с уже имеющейся энцефалопатией или другим заболеванием печени. У пациентов с нарушением функций печени декомпенсация может наступить в результате снижения перфузии органа по портальной вене.
Трансюгулярное внутрипечёночное портосистемное шунтирование при сравнении с хирургическими методами лечения и другими манипуляциями проигрывает из-за большой стоимости последующего наблюдения за состоянием шунта и повторных вмешательств.
Однако для потенциальных кандидатов на пересадку печени этот метод предпочтительнее, чем хирургическое лечение.
Применение трансюгулярного внутрипечёночного портосистемного шунтирования у пациентов с печёночной дисфункцией степени C по классификации Чайлда не привело к улучшению состояния.
Другие методы диагностики, используемые для оценки выживания и степени тяжести заболевания, применяют сразу после шунтирования. Это шкалы MELD64, BOTEM (от Bonn TIPS early mortality score — шкала ранней смертности) и исследование кровоснабжения печени.
Исследования показали, что функционирование почек, интенсивная терапия, сопутствующие заболевания и неотложное выполнение процедуры шунтирования — важные прогностические факторы в дополнение к стандартному определению функций печени, протромбинового времени, концентрации альбумина и билирубина.
Трансюгулярное внутрипечёночное портосистемное шунтирование при кровотечениях из варикозно расширенных вен
Неконтролируемое кровотечение из желудочно-пищеводных и эктопированных варикозно расширенных вен в настоящее время можно регулировать с помощью трансюгулярного портосистемного шунтирования.
Процедуру можно проводить как пациентам, нуждающимся в интенсивной терапии, так и больным с противопоказаниями к хирургическому вмешательству. Высокая смертность таких пациентов больше была обусловлена их общим состоянием, нежели проведением вмешательства.
Показатели смертности в национальном конфиденциальном расследовании причин послеоперационной летальности в Великобритании в течение 30 дней после манипуляции были равны 17%.
В этом исследовании 80% летальных исходов возникли при выполнении данной манипуляции в качестве ургентной терапии (для остановки кровотечения из варикозно расширенных вен).
В дополнение к трансюгулярному внутрипечёночному портосистемному шунтированию иногда проводят эмболизацию варикозно расширенных вен, поскольку ориентировочный доступ к портальной системе уже сформирован.
В некоторых случаях могут быть катетеризированы левые желудочные или короткие желудочные вены для последующей эмболизации варикозно расширенных вен прямо во время процедуры шунтирования (этот способ используют для остановки острого и снижения риска повторного кровотечения).
Уменьшение внепечёночного портосистемного шунтирования приводит к увеличению кровотока в портальной вене вблизи печени и наложенного шунта. В некоторых случаях это снижает риск развития энцефалопатии и способствует сохранению кровотока в шунте.
Сравнение эффективности трансюгулярного внутрипечёночного портосистемного шунтирования и склеротерапии и/или лигирования варикозно расширенных вен в качестве средства вторичной профилактики кровотечений проведено в нескольких метаанализах. Иногда дополнительно используют медикаментозную терапию.
В большинстве случаев шунтирование оказалось более эффективным методом предупреждения повторного кровотечения, но при этом улучшения показателя общей смертности выявлено не было. Энцефалопатия чаще развивалась после шунтирования.
В нескольких исследованиях трансюгулярное внутрипечёночное шунтирование выполнено при ургентной терапии интенсивного повторного кровотечения после эндоскопического лигирования. Таким образом, эндоскопические и медикаментозные методы должны быть использованы в качестве первичных мероприятий, а трансюгулярное шунтирование — лишь при их неуспехе.
После остановки кровотечения шунтирование можно успешно сочетать с медикаментозной терапией или эндоскопическим лигированием узлов, что избавит от необходимости длительного поддержания шунта в рабочем состоянии и связанных с этим рентгенологических вмешательств.
Статью подготовил и отредактировал: врач-хирург Пигович И.Б.
Источник: http://surgeryzone.net/info/info-hirurgia/vnutripechenochnoe-portosistemnoe-shuntirovanie.html

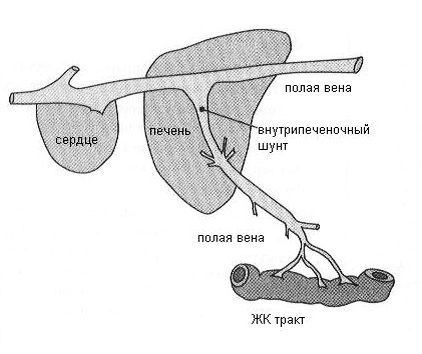 Рис.2, 2а. Схемы патологического портального кровотока
Рис.2, 2а. Схемы патологического портального кровотока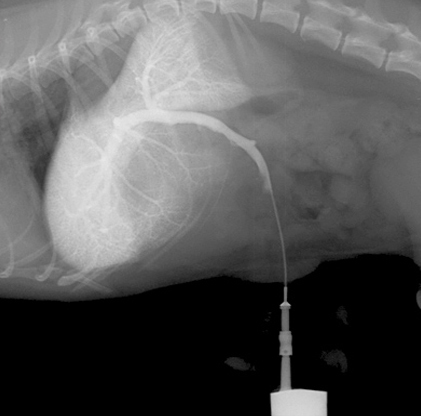 Слева — Шунт ductus venosus — сосуд, соединяющий пупочную вену с каудальной полой веной у плода.Справа — Гепатопортальная микроваскулярная дисплазия.
Слева — Шунт ductus venosus — сосуд, соединяющий пупочную вену с каудальной полой веной у плода.Справа — Гепатопортальная микроваскулярная дисплазия.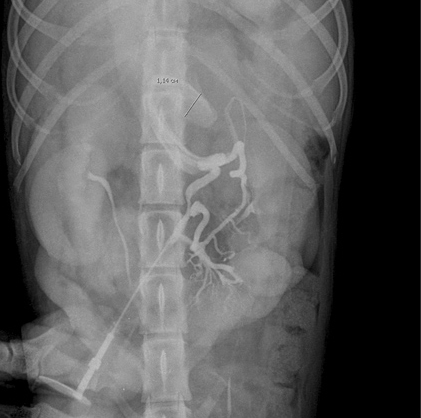 Портокавальный шунт — дренаж портальной вены в каудальную полую вену.
Портокавальный шунт — дренаж портальной вены в каудальную полую вену.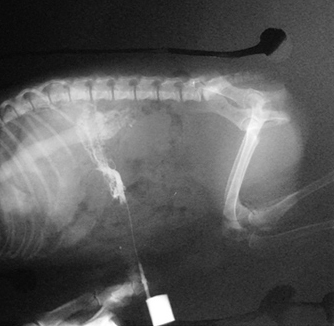 Слева — Соединение портальной вены и каудальной полой вены с непарной веной в сегмент полой вены преренально.Справа — Атрезия портальной вены (гипоплазия) с развитием множественных коллатеральных портосистемных анастомозов.
Слева — Соединение портальной вены и каудальной полой вены с непарной веной в сегмент полой вены преренально.Справа — Атрезия портальной вены (гипоплазия) с развитием множественных коллатеральных портосистемных анастомозов.